L’Influence du BDNF sur la Santé Cognitive des Personnes Âgées
Découvrez comment le BDNF influence la fonction cognitive et son rôle potentiel dans le déclin cognitif des personnes âgées.

Découvrez comment le BDNF influence la fonction cognitive et son rôle potentiel dans le déclin cognitif des personnes âgées.

Découvrez les résultats de l’essai APOLLOE4 sur ALZ-801, un traitement prometteur pour les patients APOE4 souffrant d’Alzheimer précoce.
Découvrez comment l’ergothionéine, acide aminé aux propriétés prometteuses, pourrait influencer la santé cognitive et le vieillissement. En savoir plus !

Découvrez comment le vieillissement affecte la mémoire spatiale via des changements neuronaux dans le cerveau des souris âgées. Une étude qui éclaire les mécanismes du vieillissement.

Découvrez comment la pollution de l’air influence la démence et les maladies neurodégénératives, révélant des liens inquiétants pour notre santé.

Découvrez comment la médecine moderne transforme notre compréhension du vieillissement et explorez les innovations clés pour une longévité optimale.

Introduction Anavex Life Sciences a récemment présenté les résultats de son essai clinique de Phase IIb/III sur l’Alzheimer, où un traitement quotidien de 30 mg de blarcamesine a montré des résultats cognitifs prometteurs dans une population ciblée par une approche de médecine de précision, désignée ABCLEAR3. Selon la société, ces résultats se rapprochent du vieillissement…
Mesure de la fonction cognitive La fonction cognitive peut être mesurée de différentes manières et est généralement considérée comme un ensemble de domaines influencés par divers aspects de la physiologie et de la biologie chimique du cerveau. Ces domaines, qui incluent la mémoire, la fonction exécutive, le traitement sensoriel et le contrôle cognitif, peuvent évoluer…
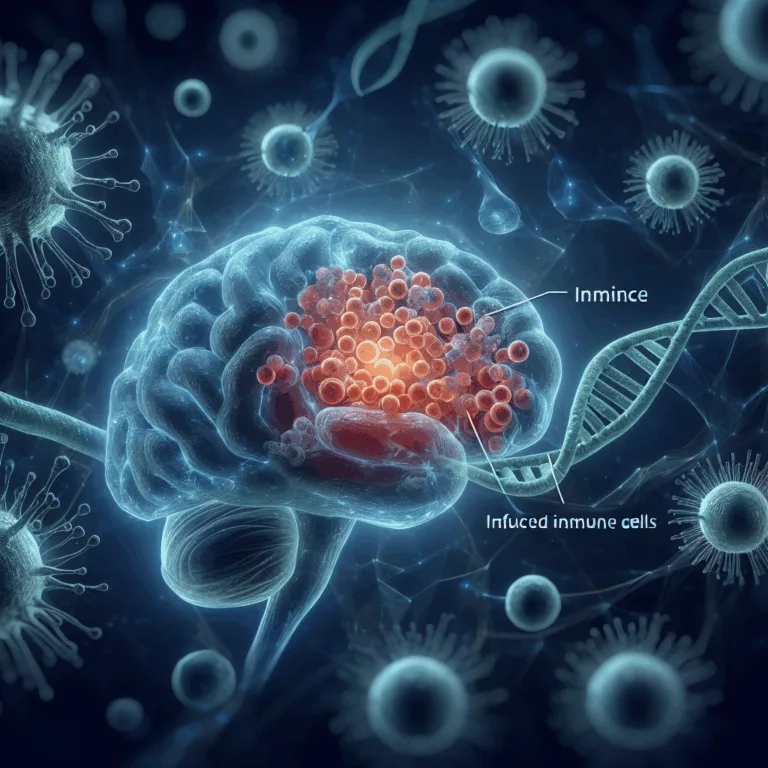
Les cellules immunitaires innées, notamment les monocytes et les macrophages, jouent un rôle crucial dans le fonctionnement des tissus corporels. Avec l’âge, ces cellules peuvent devenir dysfonctionnelles, notamment en devenant plus inflammatoires. Contrairement à d’autres parties du corps, le cerveau possède sa propre population de cellules similaires, appelées microglies. Il est donc intéressant de noter…
Au cours des dernières années, les chercheurs ont développé de nombreuses horloges de vieillissement utilisant des techniques d’apprentissage automatique appliquées à de grandes quantités de données biologiques. Ces horloges ont pour but de prédire l’âge chronologique, le risque de mortalité et d’autres mesures d’intérêt. Si une personne présente un âge prédit supérieur à son âge…