Impact à Long Terme de l’Infection par le Virus de la Grippe et le Rôle des Sénolytiques dans la Guérison Pulmonaire
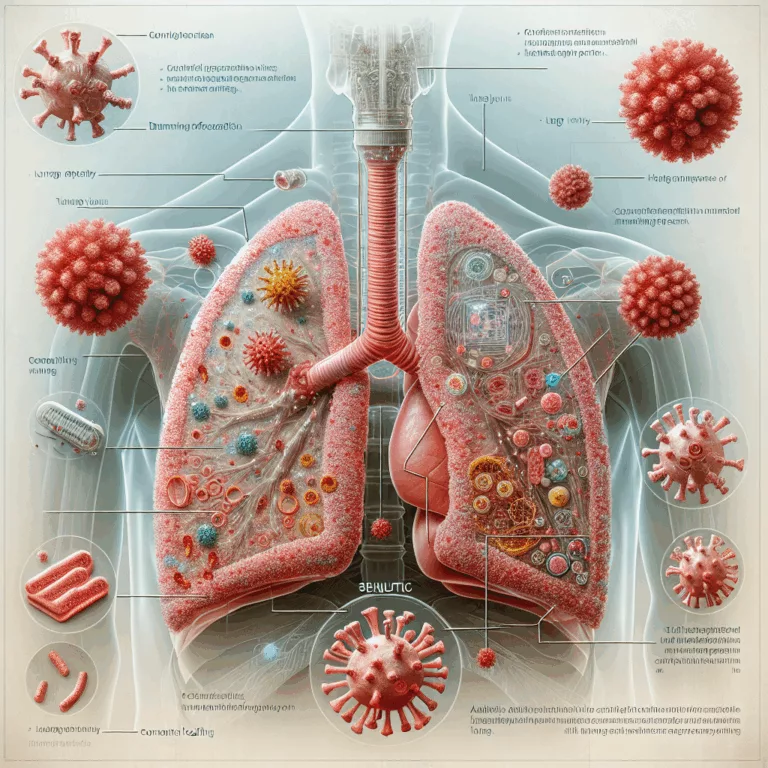
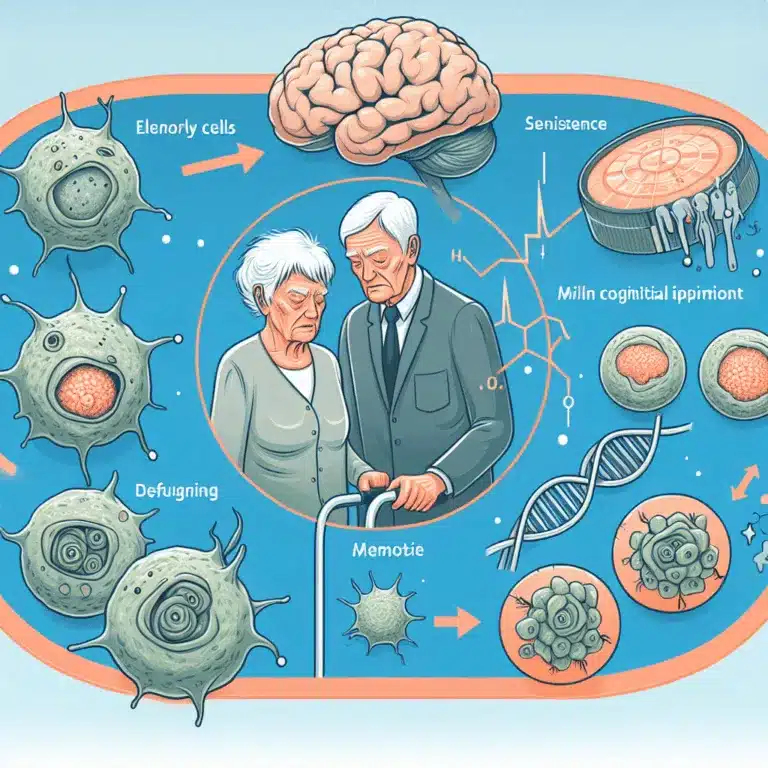
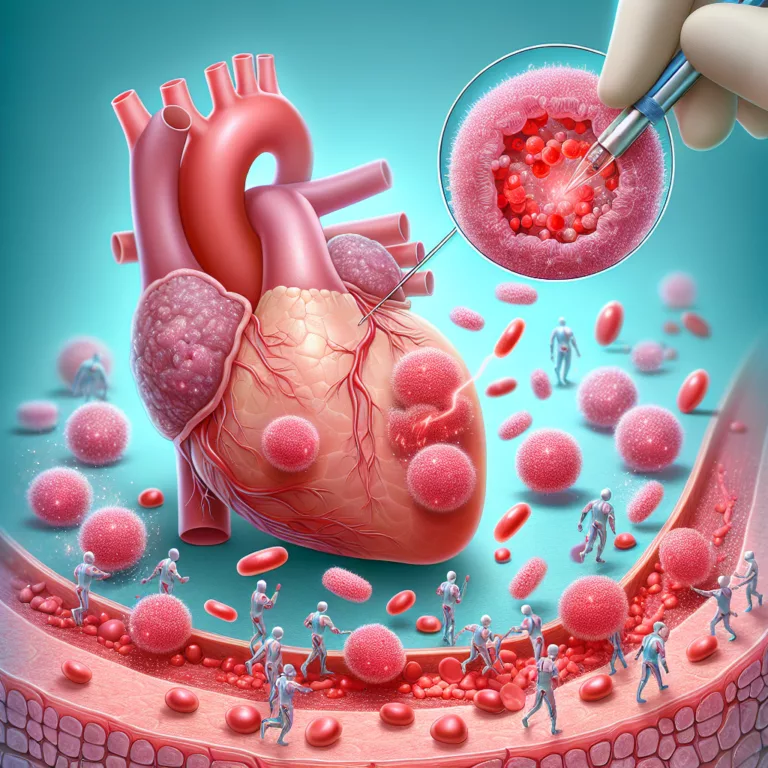
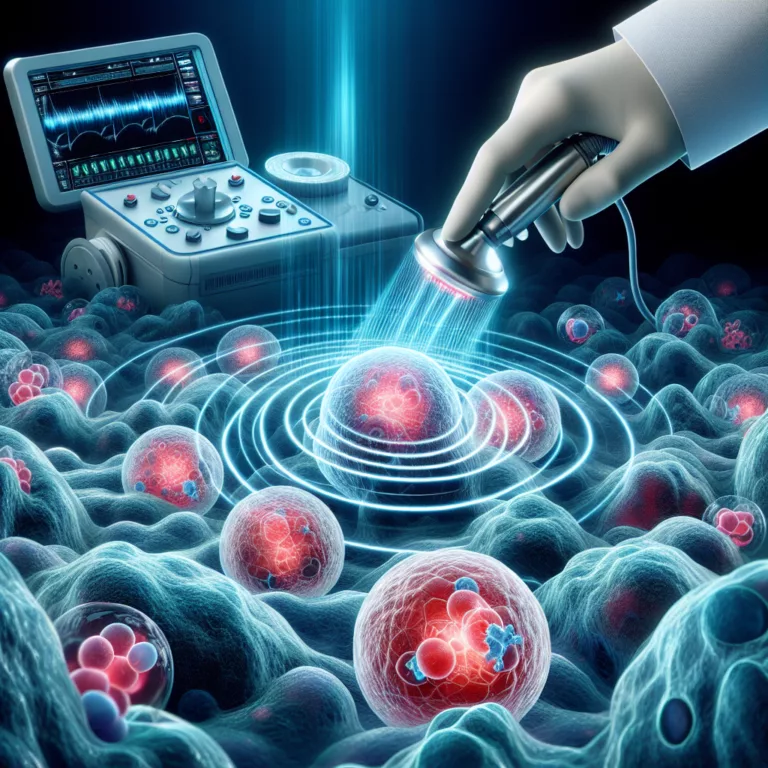
Dans une étude publiée dans la revue Aging Cell, des chercheurs ont examiné les conséquences à long terme de l’infection par le virus de la grippe chez des souris et ont exploré l’utilisation de sénolytiques pour atténuer ces effets. Ils ont constaté que des maladies pulmonaires virales, telles que la grippe, peuvent provoquer des dommages…