Stimulation Électrique et Modulation des Macrophages pour la Régénération Tissulaire
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
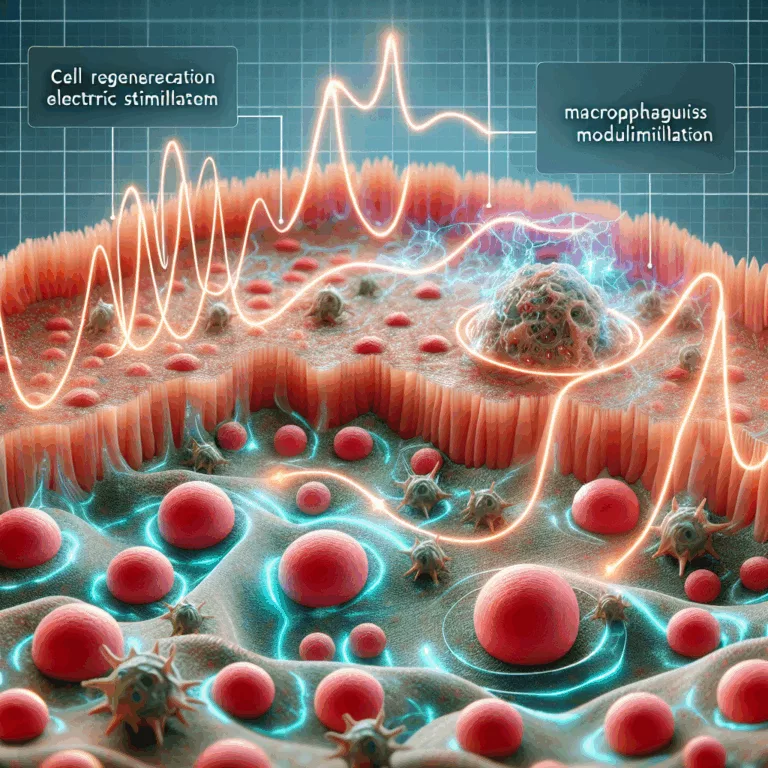
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
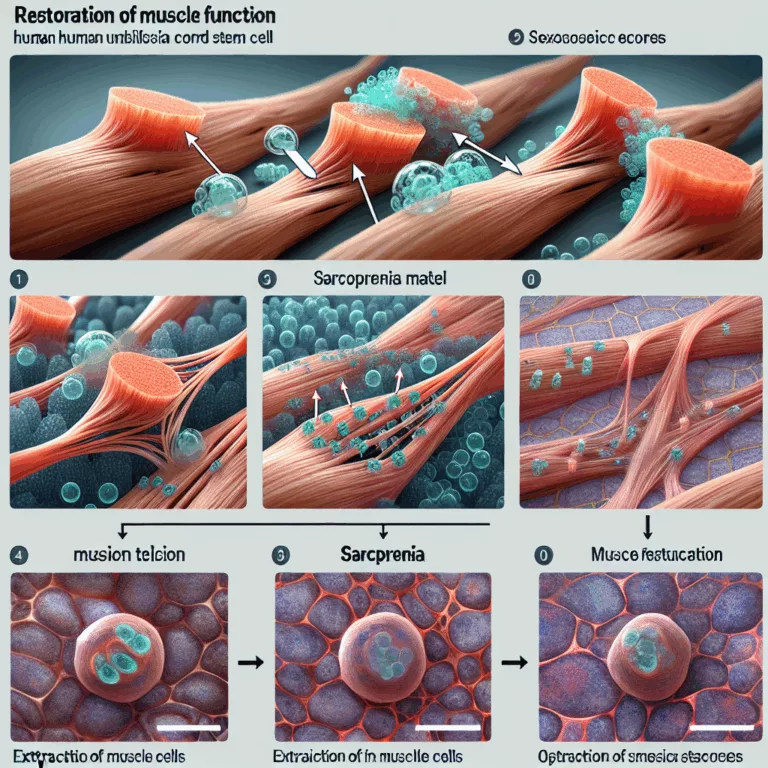
Des chercheurs ont découvert que les exosomes sécrétés par les cellules souches mésenchymateuses dérivées du tissu du cordon ombilical humain (hucMSC-Exos) restaurent la fonction musculaire dans un modèle murin de sarcopénie. Les exosomes sont des vésicules qui transportent des messages moléculaires d’une cellule à l’autre. Lorsqu’ils proviennent de sources jeunes, ils ont montré des avantages…
Des chercheurs ont découvert comment et pourquoi l’acide α-cétoglutarique (AKG) affecte la sénescence cellulaire et comment une petite molécule pourrait être utile dans ce processus. Publiés dans la revue Cell Reports, ces travaux mettent en lumière le rôle crucial de l’AKG dans plusieurs processus métaboliques fondamentaux, notamment le cycle de Krebs, par lequel les mitochondries…
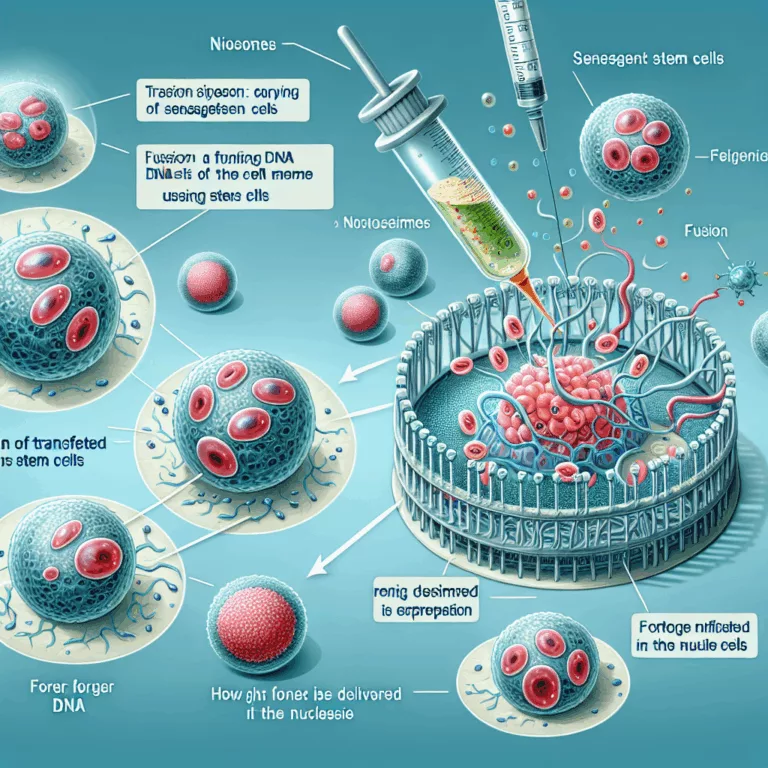
Des chercheurs ont exploré une méthode novatrice de transfection des cellules souches mésenchymateuses (CSM) sénescentes et ont publié leurs résultats dans le journal Cell : Molecular Therapy Nucleic Acids. La modification génétique chez un individu vivant est plus complexe que dans des cellules en culture, nécessitant des approches différentes. Les vecteurs viraux, bien que couramment…

Les thérapies par cellules souches ont connu une expansion notable au cours des 30 dernières années et sont désormais largement utilisées dans le domaine médical. Récemment, l’utilisation des vésicules extracellulaires en substitution aux cellules souches a émergé, particulièrement dans l’industrie du tourisme médical. Bien que ces traitements aient montré des effets sur le vieillissement et…
Les mitochondries sont des organites essentiels, souvent décrites comme les centrales énergétiques de la cellule, car elles produisent l’adénosine triphosphate (ATP), la molécule qui stocke l’énergie chimique nécessaire aux processus biochimiques cellulaires. Cependant, la fonction mitochondriale diminue avec l’âge, en partie à cause des dommages à l’ADN mitochondrial et des changements dans l’expression génique nucléaire…
Les macrophages, éléments clés du système immunitaire inné, présentent différentes polarités, notamment les macrophages M1 et M2. Les macrophages M1 sont pro-inflammatoires et attaquent les pathogènes, tandis que les macrophages M2 ont un rôle anti-inflammatoire et sont essentiels pour l’entretien des tissus. Bien qu’ils ne soient pas strictement indispensables à la guérison des blessures, leur…
Au cours des dernières années, le facteur de transcription GATA4 a été associé à divers problèmes liés à l’âge, notamment le phénomène de cicatrisation dans le tissu cardiaque. Plus généralement, GATA4 est lié à la sénescence cellulaire, un problème majeur du vieillissement. Les cellules sénescentes s’accumulent avec l’âge, perturbant la structure et la fonction des…
Une équipe de chercheurs a proposé une nouvelle approche utilisant l’ARNm pour prévenir la sénescence et renforcer les cellules souches mésenchymateuses (CSM) contre le vieillissement avant leur transplantation chez les patients. Ce travail met en lumière les problèmes de translationalité associés aux CSM, notamment leur tendance à devenir sénescents durant le processus de réplication, principalement…

La communauté clinique qui pratique les thérapies par cellules souches de première génération s’oriente progressivement vers la récolte des vésicules extracellulaires issues des cellules en culture, plutôt que vers les transplantations de cellules souches. Dans la plupart des cas, presque toutes les cellules souches transplantées meurent, et les effets de ces thérapies sur les maladies…