L’avenir prometteur des exosomes dérivés de cellules souches dans le tourisme médical
Découvrez comment les exosomes issus de cellules souches révolutionnent le tourisme médical et leurs applications dans diverses pathologies.

Découvrez comment les exosomes issus de cellules souches révolutionnent le tourisme médical et leurs applications dans diverses pathologies.

Découvrez comment l’exercice peut inverser la perte de densité capillaire liée à l’âge et améliorer la santé musculaire.
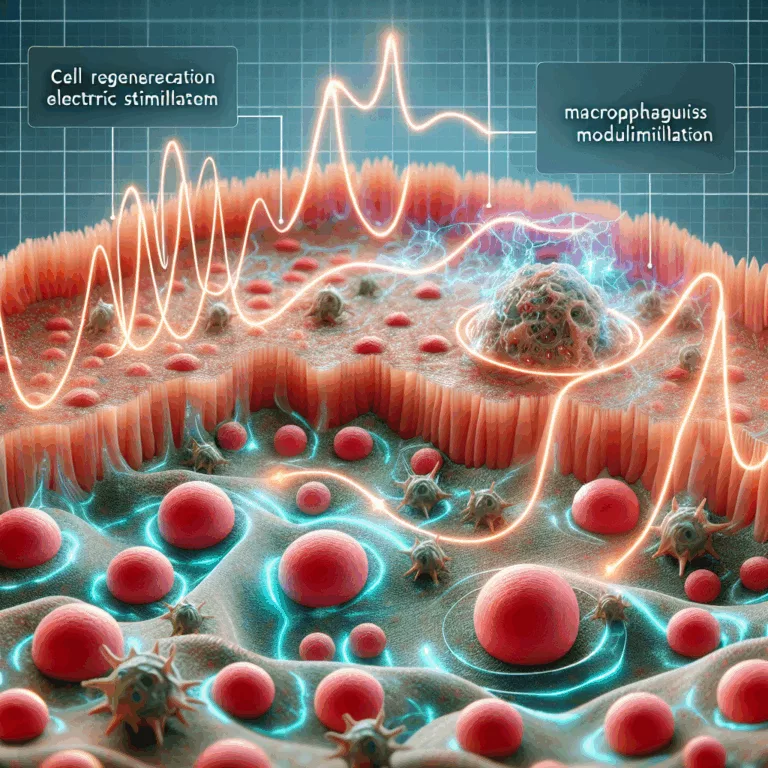
Découvrez comment la stimulation électrique modifie les macrophages pour accélérer la régénération tissulaire et ouvrir de nouvelles voies en médecine régénérative.
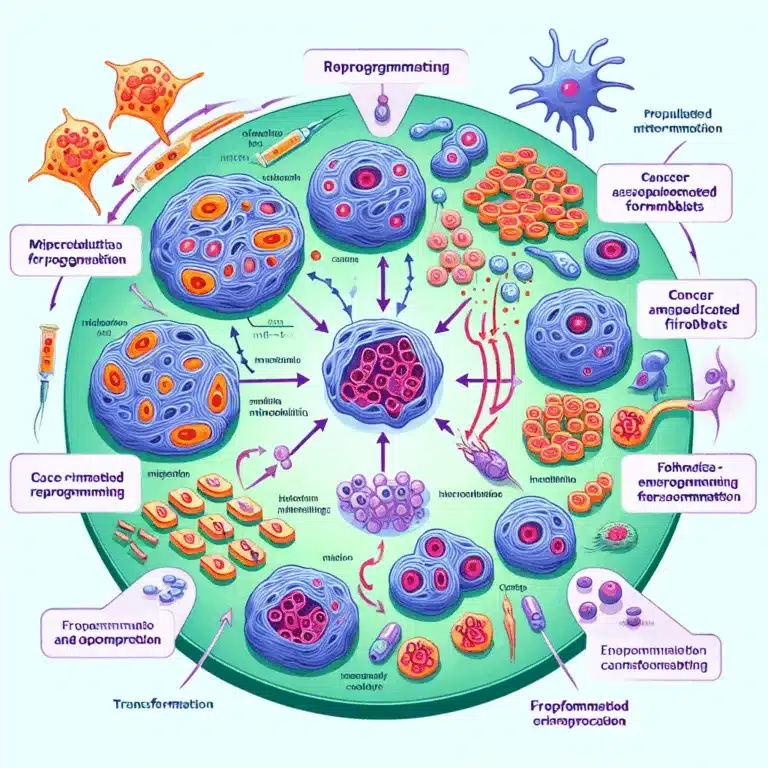
Les scientifiques ont découvert que les cellules cancéreuses recrutent des fibroblastes pour soutenir la croissance tumorale en leur transférant des mitochondries. Cette découverte ouvre de nouvelles pistes pour le traitement du cancer. En effet, les cellules cancéreuses ne fonctionnent pas seules ; leur succès repose souvent sur la coopération avec les cellules environnantes. Ces dernières…

La reprogrammation cellulaire est une approche prometteuse pour traiter le vieillissement en induisant l’expression des facteurs de Yamanaka pendant une période limitée. L’objectif est de modifier l’état épigénétique des cellules pour qu’il devienne plus jeune, tout en préservant leur fonction et en évitant la formation de cellules souches pluripotentes potentiellement nuisibles. Des recherches antérieures ont…
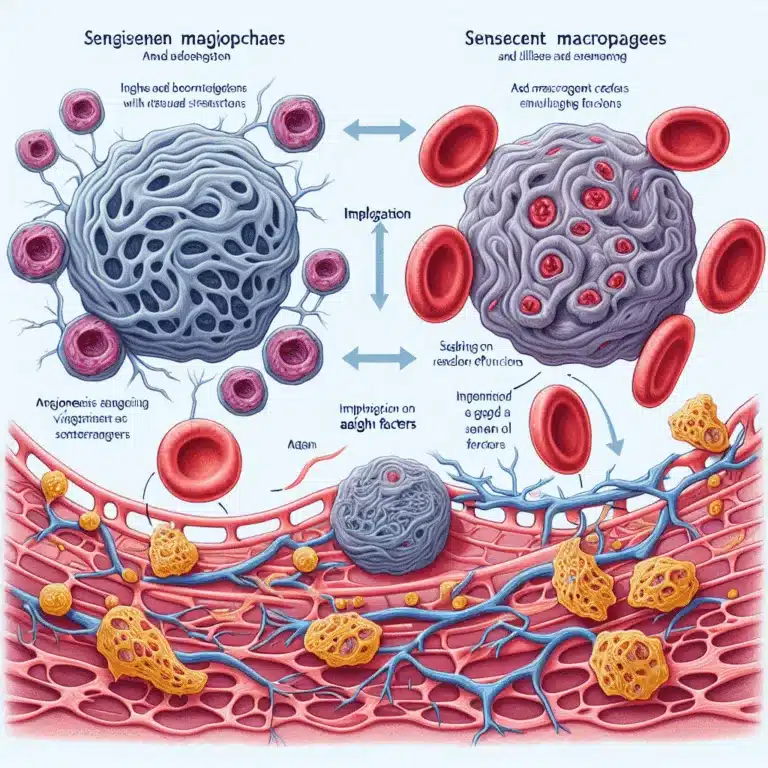
L’incapacité à générer de nouveaux vaisseaux sanguins diminue avec l’âge, entraînant une perte de capillaires et une densité réduite des tissus. Ce phénomène complique le développement de thérapies visant à traiter des conditions comme la maladie artérielle périphérique, qui est souvent causée par un flux sanguin réduit en raison de plaques athéromateuses. Des recherches récentes…
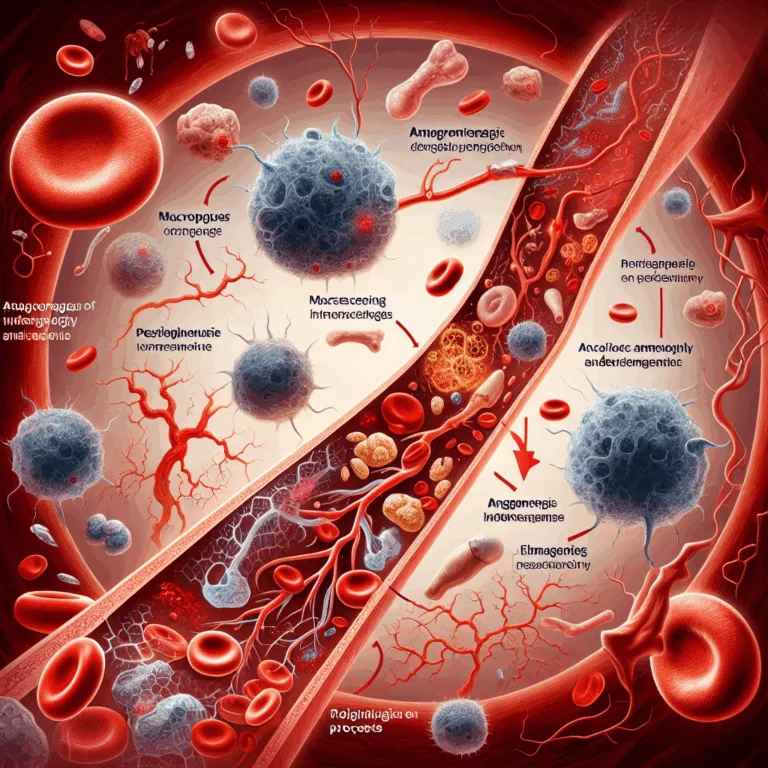
Dans une étude publiée dans Aging Cell, des chercheurs ont établi un lien entre la sénescence des macrophages et l’échec de la formation de nouveaux vaisseaux sanguins, ce qui pourrait faciliter le traitement des obstructions artérielles. Les problèmes causés par des vaisseaux sanguins obstrués ne se limitent pas aux crises cardiaques et aux AVC, mais…
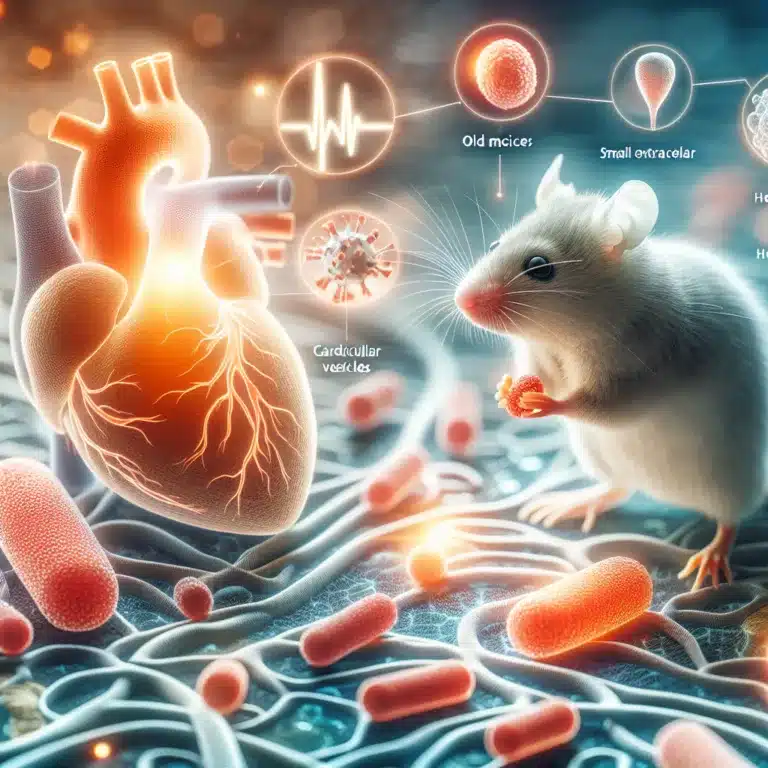
Dans une étude publiée dans la revue *Stem Cell Research & Therapy*, des chercheurs ont découvert que les petites vésicules extracellulaires (sEVs) provenant de souris jeunes peuvent atténuer les dysfonctionnements cardiaques chez les souris âgées. Les vésicules extracellulaires ont été classées selon leur origine, mais la séparation actuelle repose principalement sur leur taille, avec une…
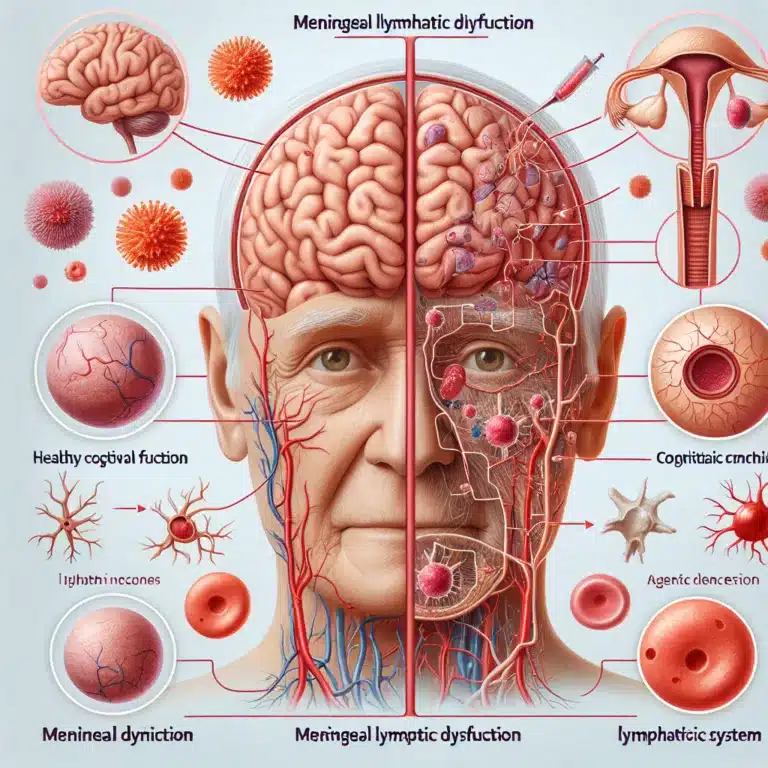
Le liquide céphalorachidien (LCR) est produit en permanence, circule dans le cerveau et s’évacue dans le corps. Ce flux transporte les déchets métaboliques du cerveau, et les chercheurs commencent à considérer l’altération liée à l’âge de l’évacuation du LCR comme une contribution significative à la perte de fonction cognitive et au développement de conditions neurodégénératives…
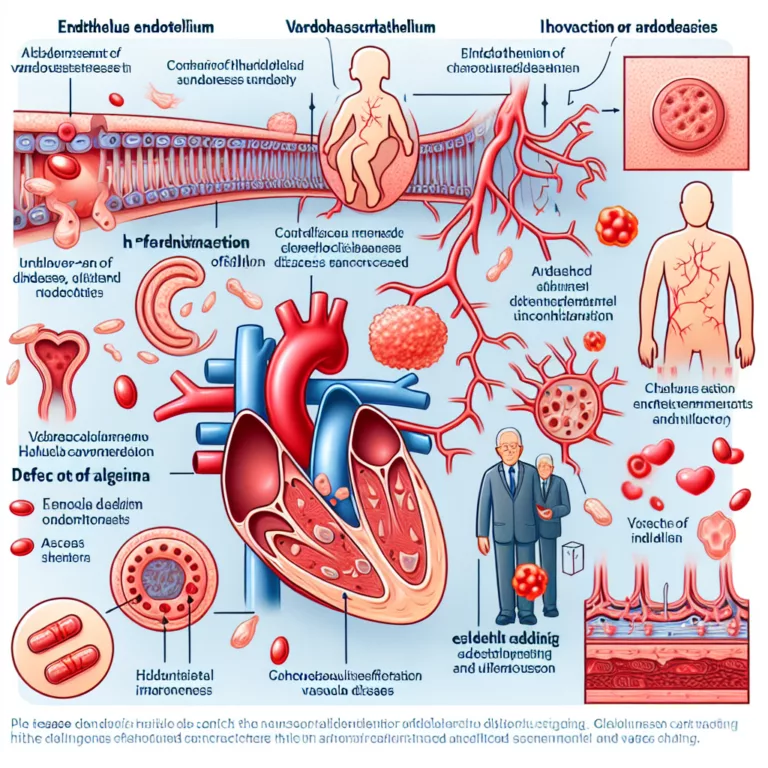
L’endothélium est la couche interne des vaisseaux sanguins et joue un rôle crucial dans plusieurs fonctions vitales du système vasculaire, allant de la régulation sélective du passage des molécules à la contraction et dilatation appropriées des vaisseaux sanguins. Les dommages localisés et l’inflammation de l’endothélium constituent une étape précoce dans la formation d’une plaque athéroscléreuse….