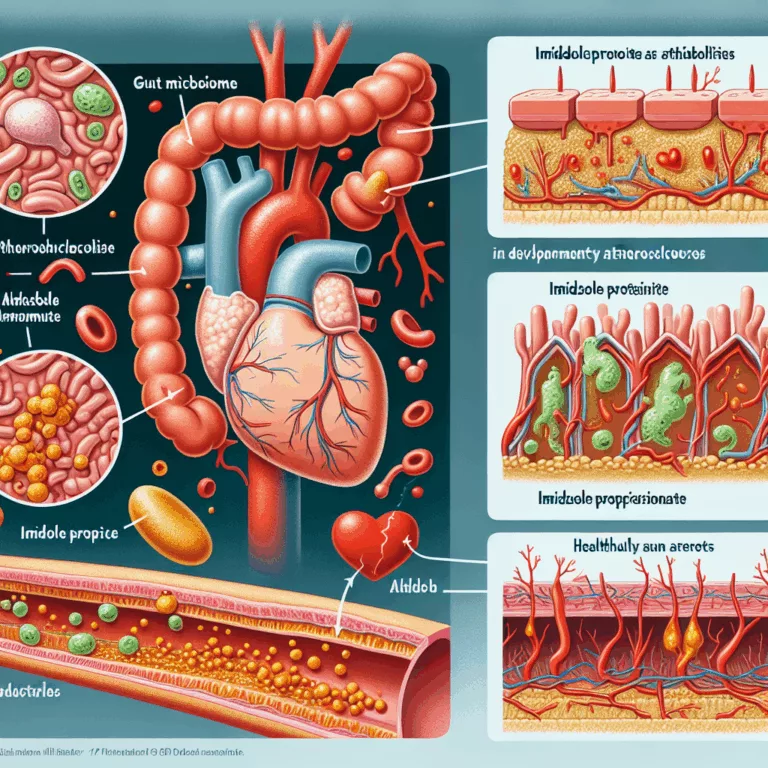
Rôle du Microbiome Intestinal et de l’Imidazole Propionate dans l’Athérosclérose
La plupart des personnes qui arrivent à l’hôpital après une première crise cardiaque ou un AVC causé par la rupture d’une plaque athérosclérotique instable dans les artères n’ont pas de taux élevé de cholestérol LDL. Ce cholestérol, qui est transporté par les particules LDL provenant du foie, est reconnu comme contribuant à la croissance des…