Elamipretide : Première thérapie approuvée pour le syndrome de Barth
Découvrez l’Elamipretide, la première thérapie approuvée pour le syndrome de Barth, et son potentiel révolutionnaire pour améliorer la fonction mitochondriale.

Découvrez l’Elamipretide, la première thérapie approuvée pour le syndrome de Barth, et son potentiel révolutionnaire pour améliorer la fonction mitochondriale.

Découvrez comment améliorer la fonction mitochondriale pourrait inverser le déclin lié à l’âge et favoriser une meilleure santé cellulaire.

Découvrez comment le vieillissement affecte la mémoire spatiale via des changements neuronaux dans le cerveau des souris âgées. Une étude qui éclaire les mécanismes du vieillissement.
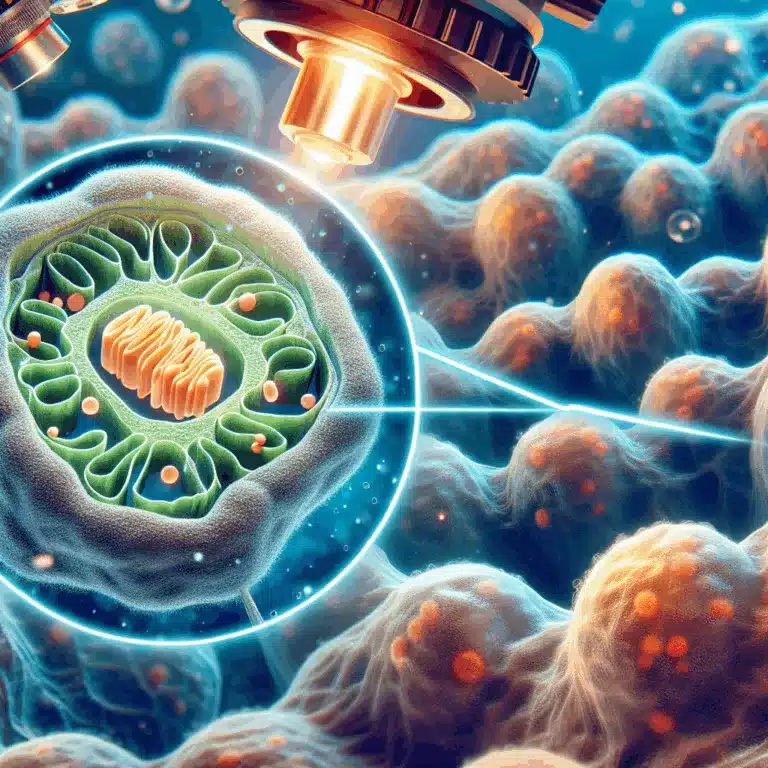
L’approbation de Forzinity par la FDA révolutionne la médecine mitochondriale, promettant des avancées majeures pour la longévité et le traitement des maladies liées à l’âge.
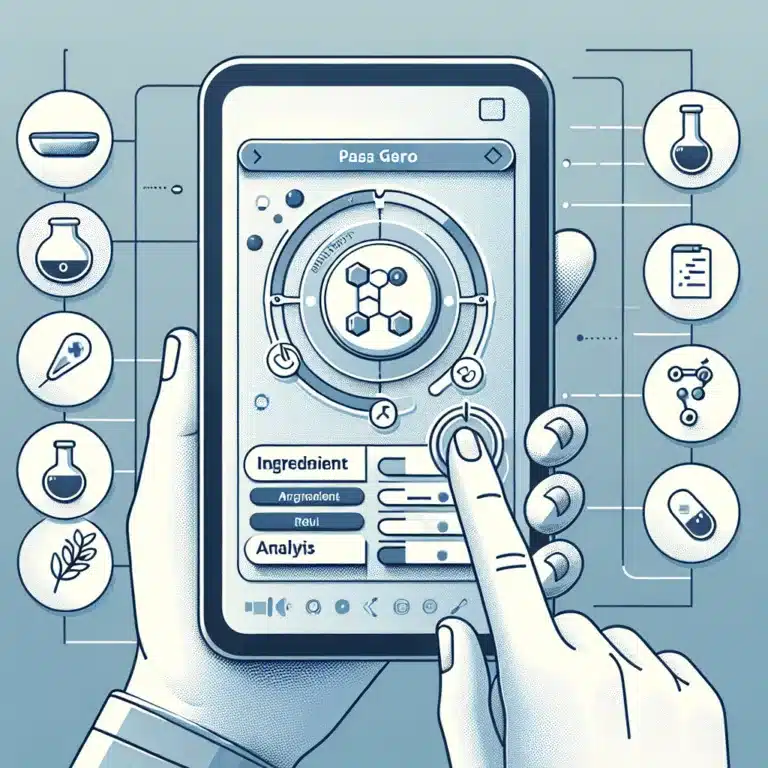
Découvrez PASS GERO, l’application innovante qui évalue les composés anti-âge et révolutionne notre approche du vieillissement et de la santé préventive.
Découvrez comment l’excès de tissu adipeux influence la progression de la maladie d’Alzheimer et son lien avec l’inflammation et la neurodégénérescence.
Découvrez comment l’IL-33 influence l’arthrose et explorez une stratégie innovante avec des nanoparticules pour ralentir sa progression.

Découvrez comment la perte de coordination de l’expression génique pourrait révéler les mécanismes secrets du vieillissement biologique.

Deepcell s’associe à InGel Therapeutics pour révolutionner les thérapies cellulaires oculaires. Découvrez comment l’IA transforme la vision des patients.

Rona Therapeutics innove avec RN3161, un siRNA prometteur contre l’obésité ciblant le gène INHBE. Découvrez son potentiel révolutionnaire pour la santé métabolique.